近日,我院陈果教授团队在生命科学学科顶尖期刊Oncogene (IF:8.7)上发表最新研究成果“Targeting CK2-mediated phosphorylation of p53R2 sensitizes BRCA-proficient cancer cells to PARP inhibitors”。我院博士研究生王聪、暨南大学基础医学院硕士研究生田玲、何强为本文共同第一作者,我院陈果教授、南京市妇幼保健院李大可主任医师,我院青年教师朱波博士为本文共同通讯作者。中国药科大学生物药物学院为本文第一通讯单位。
不受控制的细胞分裂与DNA复制是肿瘤的主要特征之一。失控的DNA复制会在肿瘤细胞内产生不间断的内源性DNA损伤,通常为DNA单链断裂。作为DNA损伤感受器,聚ADP核糖聚合酶 (Poly ADP-ribose Polymerase,PARP)在肿瘤细胞DNA单链断裂修复中发挥关键作用。当PARP功能被抑制时,肿瘤细胞内源性的DNA单链断裂无法及时修复,将积累大量的DNA双链断裂。PARP抑制所造成的DNA双链断裂依赖于BRCA1/2介导的同源重组修复。基于此,PARP抑制剂被开发并批准用于BRCA1/2突变肿瘤的精准治疗。作为首款基于合成致死原理获批的临床抗癌药物,PARP抑制剂已广泛用于BRCA1/2突变卵巢癌与乳腺癌的维持治疗。
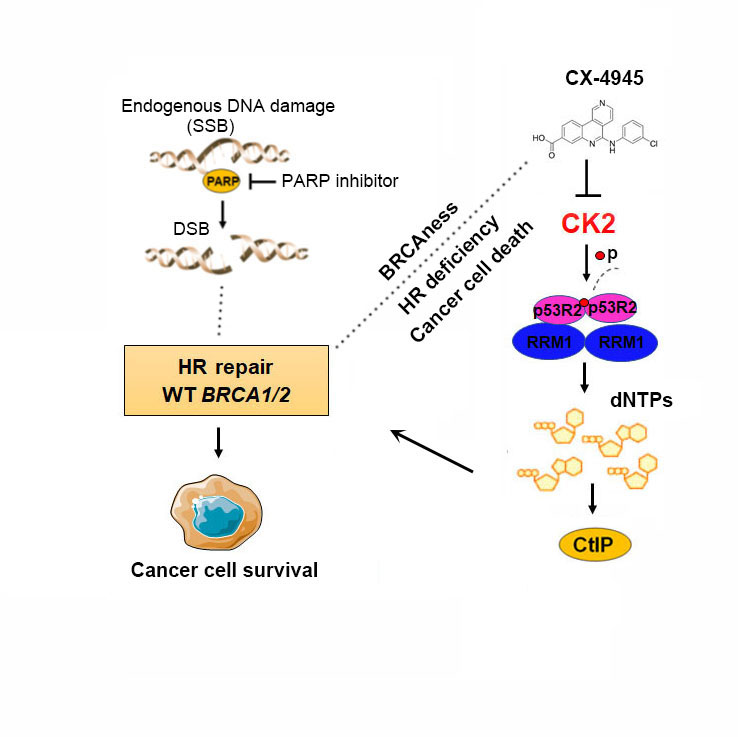
然而,携带BRCA1/2突变在卵巢癌或乳腺癌患者不到30%,大部分BRCA1/2野生型的卵巢癌患者对PARP抑制剂不敏感。陈果教授团队首次报道,核糖核苷酸还原酶小亚基p53R2在肿瘤中高表达,并可通过调控CtIP稳定性影响同源重组修复。本研究进一步发现,酪蛋白激酶II (CK2)可通过磷酸化p53R2 (Ser20)位点,促进核糖核苷酸还原酶的组装与活性发挥,从而保证同源重组修复所需的dNTPs原料供给。因此,靶向CK2可通过抑制BRCA1/2野生型肿瘤细胞同源重组修复因子CtIP表达及dNTPs原料合成,增强BRCA1/2野生型肿瘤细胞对PARP抑制剂的敏感性。综上所述,本研究揭示了一种抑制同源重组修复的新途径,为PARP抑制剂在BRCA1/2野生型癌症患者治疗中的应用提供了一种全新的策略。
以上工作获得国家自然科学基金等项目的资助。论文链接:https://www.nature.com/articles/s41388-023-02812-5
示意图

